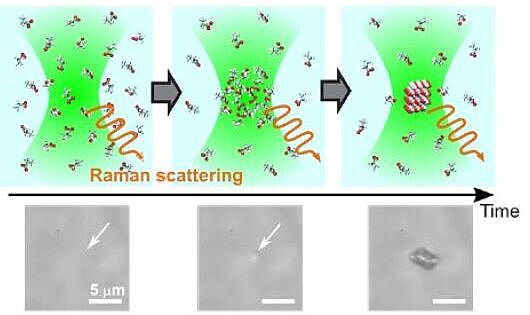
Kristallisation ist ein Prozess, der in der Natur häufig anzutreffen ist, beispielsweise bei der Bildung von Nierensteinen, Korallen oder Schneeflocken. Dabei wird eine flüssige oder gasförmige Substanz in Kristalle umgewandelt. In der Pharmaindustrie wird Kristallisation für die Bildung von Wirkstoffen eingesetzt und auch in der Lebensmittelverarbeitung ist sie von grosser Bedeutung. Diesem Phänomen geht die Phase der Nukleation voraus, dort organisieren sich einzelne Moleküle einer bestimmten Substanz über physikalische und chemische Wechselwirkungen zu Molekülclustern, also «Kernen». Dadurch schaffen sie die optimalen Bedingungen für die Entwicklung und das Wachstum eines Kristalls. Diese Dynamik zu beobachten, war bisher schwierig, da sie stochastisch abläuft.
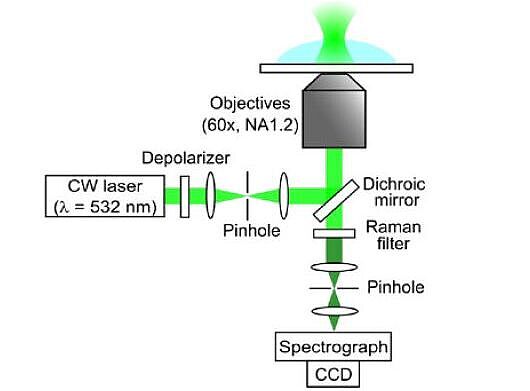
Das bedeutet, dass es nicht vorhersehbar ist, wann und wo eine Kristallisation beginnt. Also waren Beobachtungen und Visualisierungen des Phänomens auf molekularer Ebene bislang ein Glücksfall. Das Forscherteam um Prof. Takuji Adachi am Departement für Physikalische Chemie der Universität Genf (UNIGE) hat seinem Glück mit einem findigen Ansatz auf die Sprünge geholfen. Den Wissenschaftlern ist es gelungen, die Nukleation eines einzelnen Kristalls mittels optischer Spektroskopie auf mikrometrischer Ebene in Echtzeit und auf Raumtemperatur zu beobachten. Ein Continuous-wave (CW)-Laser diente dazu, die Kristallkeimbildung auszulösen. Am Ort des Laserlichteinfalls werden Moleküle angezogen, was auch die Wahrscheinlichkeit erhöht, dass sie genau dort aggregieren und einen Keim bilden. An dieser Stelle legte sich das Team mit dem Raman-Mikrospektroskop auf die Lauer und wurde belohnt: Der Laser, der schon die Moleküle angezogen hatte, wurde simultan auch zur Detektion der molekularen Zusammensetzung der Materie während der Nukleation und Kristallisation eingesetzt. Sobald der Keim gross genug war, konnte er zusätzlich im Hellfeldmikroskop mit blossem Auge beobachtet werden.
Für diese Experimente wählten die Forscher Glycin als Modellsubstanz, eine einfache Aminosäure, die wasserlöslich ist und als Baustein für Proteine dient. Im Interview sprach Innovation Chemie Pharma mit Prof. Takuji Adachi über das Experiment und wie es in der Chemie- und Pharmaindustrie dazu beitragen kann, gezielter und günstiger Substanzen und Wirkstoffe zu synthetisieren.
Professor Adachi, Ihre Arbeit könnte den Weg für sicherere und stabilere Wirkstoffe bereiten. Bitte erläutern Sie, wie Sie Ihre Methode entwickelt haben, was die Vorteile, aber auch die Grenzen sind.
Als ich damit anfing, ähnelten Kristallisations-Projekte dem Kochen, um ein neues Rezept zu entwickeln. Wir testeten verschiedene Bedingungen und es war viel Ausprobieren involviert. Der stochastische Ablauf der Kristallkeimbildung macht es schwierig, sie zu beobachten, weil man kaum vorhersagen kann, wann und wo sie stattfinden wird. Viele Details sind zwar theoretisch abgehandelt, aber in der Praxis noch nicht nachgewiesen.
Um den Prozess näher betrachten zu können, suchte ich nach einem Weg, ihn in einem kleinen Volumen einzugrenzen und kam auf die Idee, den CW-Laser als «optische Pinzette» auszuprobieren: Der Laser ist durchgängig eingeschaltet, das zieht Moleküle an und dadurch erhöht sich lokal in einem 300- bis 400-Nanometerbereich die Konzentration der Moleküle. Der Ablauf ist immer noch stochastisch, aber wir haben mehr Kontrolle, weil wir den Ort besser eingrenzen können. Wir haben gewollt den Bias unseres Lasers minimiert, indem wir den Strahl depolarisiert haben. Danach ist es bestenfalls nur eine Frage der Zeit, wann wir eine Nukleation beobachten können. Wenn es nicht innerhalb einer Stunde klappt, brechen wir ab, bereiten eine neue Probe vor und versuchen es erneut. Vorteilhaft ist, dass die Methode labelfrei abläuft, also nicht mit störenden Zusatzmolekülen gearbeitet werden muss, um den Prozess zu visualisieren.
Wie findet die Nukleation statt?
Darüber gibt es viele Spekulationen. Normalerweise werden Experimente sehr statistisch durchgeführt. Unter verschiedenen Bedingungen wird beobachtet, wie viele Kristalle über Zeit entstehen – also die Nukleationsraten. Dann werden typischerweise Theorie und Experimente anhand dieser Werte verglichen.
In unserem Fall kommen Theorie und Feldforschung bereits an einem Zwischenstadium zum Zuge und nicht am Ende bei den Nukleationsraten. Mit der nun von uns entwickelten «Single crystal nucleation spectroscopy» (SCNS), konnten wir die Präsenz der Pränukletionsaggregate im Glycin-Kristallisationsprozess identifizieren und darüber hinaus auch ihre Raman-Spektren messen. Parallel haben unsere Kooperationspartner der McGill University komplexe Simulationen durchgeführt, um einige Glycin-Aggregate in Wasser zu ermitteln und deren Raman-Spektren berechnet. Durch das Zusammenführen von Experiment- und Simulationsdaten haben wir die mögliche Struktur der ersten Aggregate vor der Keimbildung ermittelt und daraus eine angemessene Hypothese über den weiteren Verlauf der Keimbildung bis zur Entstehung eines Kristalls entwickelt.
Sie können also nun sagen, wie die Keimbildung abläuft?
Zumindest für die Glycin-Kristallisation in Wasser wissen wir es nun besser. Es hat sich gezeigt, dass der Ablauf in unserem Experiment folgendermassen ist: Über Wasserstoffbrücken lagern sich Moleküle zusammen und bilden lange Ketten, die wiederum Cluster formen. Daraus entwickelt sich der Keim und anschliessend der Kristall. Das kann sehr schnell passieren. Können Sie mithalten? Raman-Spektroskopie ist eine relativ langsame Methode, aber wir konnten sie beschleunigen mit Spektren alle 50 Millisekunden.
Wir arbeiten derzeit am Detektor, damit wir schneller, etwa alle 5 Millisekunden, detektieren können und eine höhere zeitliche Auflösung erhalten. Ausserdem wollen wir uns nicht auf Raman-Spektroskopie beschränken, sondern eine Plattform aufbauen, auf der wir weitere Methoden und Werkzeuge kombinieren können.
Ist mit Ihrer Methode ausschliesslich Grundlagenforschung oder auch angewandte Forschung möglich?
Beides. Wir verwenden Glycin und Kochsalz – beides relativ einfache Moleküle – für unsere Grundlagenforschung und haben dazu in unserer Veröffentlichung ein Raman-Spektrum von 300 bis 3700 cm-1 Wellenlänge beschrieben.
Um Fragestellungen zu untersuchen, die für die chemisch-pharmazeutische Industrie interessant wären, ist die so genannte Low-Frequency- oder THz-Raman-Spektroskopie nützlich. Dort betrachtet man die Niederfrequenz-Region, also einen anderen Bereich des Raman-Spektrums, um Polymorphismen zu differenzieren. Das wollen wir künftig implementieren, um klarer zu sehen, was während des Phasenübergangs passiert. Einige Gruppen arbeiten bereits daran und in der Pharmaindustrie kommt die Methode bei der Synthetisierung von Substanzen bereits zum Einsatz, um herauszufinden, welche Strukturen ein Molekül bei der Synthese annehmen kann und welche davon am stabilsten ist.
Dafür ist es wichtig, zu verstehen wie der Weg der Kristallisation verläuft und welche Prozesse dabei ablaufen, um zu unterschiedlichen Formen zu gelangen. Optische Spektroskopie in situ kann an dieser Stelle sehr hilfreich sein. Manchmal ist die Form, die wir für meta-stabil halten schon recht stabil. Oder ein Wirkstoff könnte zu einer noch stabileren Form konvertieren, nachdem er einige Zeit gelagert wurde. Jede Substanz hat wahrscheinlich ihre eigene Kristallisationsgeschichte und unsere Methode kann spezifisch auf jede Fragestellung angepasst werden, die in der Industrie aufkommt. Ein anderes angewandtes Beispiel im Feld der laserinduzierten Kristallisation ist die enantioselektive Kristallisation. Es gab bereits Bemühungen, zirkuläres polarisiertes Licht zu nutzen, um nur eines der Enantiomere anzuziehen und anschliessend enantioreine Substanzen zu kristallisieren. Das ist zwar nicht ganz einfach, aber wenn man die Separation nach D und L (R und S) bei einer Mixtur verschiedener Formen in hoher Reinheit erreichen könnte, wäre das ein grosser Fortschritt.
Können Sie mit Ihrer Methode beim Troubleshooting bei schwierigen Kristallisationen helfen?
Das wäre sicher in unserem Interesse. Zum Beispiel könnten wir Substanzen aus fehlgeschlagenen Versuchen anschauen und spektroskopisch analysieren. Wir könnten dadurch vielleicht Ideen bekommen, wie sich Moleküle in fehlgeschlagenen Kristallisationen zusammengelagert haben. Zusätzlich könnte man von Rückständen auch eine Röntgenstrukturanalyse machen und basierend auf den Ergebnissen weitermachen. Es wäre immer noch ein langer Weg, bevor man wirklich sagen kann, was zu tun ist, damit die Kristallisation zustande kommt, aber wir forschen in diese Richtung weiter.
Es gibt auch unerwünschte Kristallisationen, zum Beispiel Nierensteine. Könnte Ihre Methode auch dabei helfen, Kristallisationen zu verhindern?
Eine interessante Frage. Es gibt Gruppen, die mit der Pharmaindustrie zusammenarbeiten und verschiedene Wirkstoffe bei der In-situ-Kristallisation testen. Dabei werden Nierenstein-Kristalle erzeugt und die Oberflächenstruktur analysiert, um Auswirkungen unterschiedlicher Substanzen auf das Kristallwachstum oder gar den Abbau von Kristallen zu untersuchen. Wir haben es noch nicht versucht, aber wenn wir mit unserer Methode Nierenstein-Kristalle erzeugen können und den Ansätzen Wirkstoffe zufügen, könnten wir Beobachtungen und Studien durchführen. Unser eigentliches Ziel ist es jedoch, dass eine Kristallisation zustande kommt und nicht, dass sie verhindert wird (Adachi lacht).
Doch es ist ein spannende Richtung, über die ich mir gern weitere Gendanken mache.
Diese Arbeit ist Ihre erste Veröffentlichung in diesem jungen Team und Sie haben gleich etwas Grosses erreicht.
Also wie gross diese Entdeckung ist, wird sich noch zeigen, aber wir wollen auf jeden Fall weiter forschen und weitere Details offenbaren, die sich uns bisher noch entziehen